・はじめに
環境保全型農業レポート「No.334 農林水産省は野菜の適正施肥管理の指示を撤回したのか?」に記したように,渡辺和彦らは,硝酸塩はこれまで人体に対して有害とみなされてきたが,生体内でアルギニンから一酸化窒素(NO)合成酵素によって生じたNOが,血管を拡張して血流を高めると同時に血圧を下げるといった重要な働きをしていること,また,食物から摂取した硝酸塩・亜硝酸塩からもNOが生成されて,重要な働きを行なっていることから,NOや野菜の硝酸塩には従来考えられた毒性がないこと,そのため,野菜の施肥で窒素肥料の削減を行なう必要がないことなどを主張した。
これに対して筆者は,同レポートの中で,NOはフリーラジカルであり,生体内でNO合成酵素由来のNOが産生されているのに加えて,血液に蓄積した硝酸塩や亜硝酸塩からもNOが生成されたら,NOによる酸化作用によって何らかの害作用が生じないのか,という疑問を消すことができないことを述べた。さらに,野菜では硝酸塩含量が高いほど,健康維持に重要な働きをしている抗酸化物質含量が低下する上に,現在の野菜での過剰施肥が水質汚染などの環境汚染き起こしている現状を継続し続けることは許されることではないことなどの意見を記した。
そこで今回のレポートでは,食物中の硝酸塩・亜硝酸塩の生理作用に関する研究の最近の情報をより正確に理解するために,下記の文献で得た知見を紹介する。
(5)日本学術会議土壌・肥料・植物栄養学研究連絡委員会・日本土壌肥料学会 (1998) 土と水と食品の中の硝酸をめぐる諸問題
(6)IARC (2006) Preamble to the IARC Monographs on the Evaluation of Carcinogenic Risks to Humans.
(9)国立がん研究センター (2015) 赤肉・加工摂取量と大腸がん罹患リスクについ−多目的コホート研究(JPHC研究)からの成果.
(10)食品安全委員会 (2015) レッドミートと加工肉に関するIARCの発表についての食品安全委員会の考え方.
(11)食品安全委員会 (2012) 清涼飲料水評価書.硝酸性窒素・亜硝酸性窒素.
Khatriら(文献3)は,20年前には亜硝酸塩は(体内で容易に亜硝酸塩に還元される硝酸塩も)極めて有害と考えられていたこと,そして,硝酸塩−亜硝酸塩−NO系路は過去20年間にわたる紆余曲折をへて解明されたものであることを記している。そのため,硝酸塩や亜硝酸塩の生理作用や有害性についての知見は,最近になってようやく新たに整理し直されたばかりである。日本学術会議土壌・肥料・植物栄養学研究連絡委員会と日本土壌肥料学会が,1998年に「土と水と食品の中の硝酸をめぐる諸問と題する公開シンポジウムを開催した(文献5)。上記シンポジウムが開かれた1998年には,アメリカのファーチゴットらが,循環器系における情報伝達物質としての一酸化窒素に関する発見で,ノーベル医学・生理学賞を受賞した。しかし,当時は,一酸化窒素と食品中の硝酸塩の問題を結び付けて理解するには至っていなかった。この点を含めて,以下に最近の研究の進展の一端を紹介する。
・NO合成酵素によるNOの生成
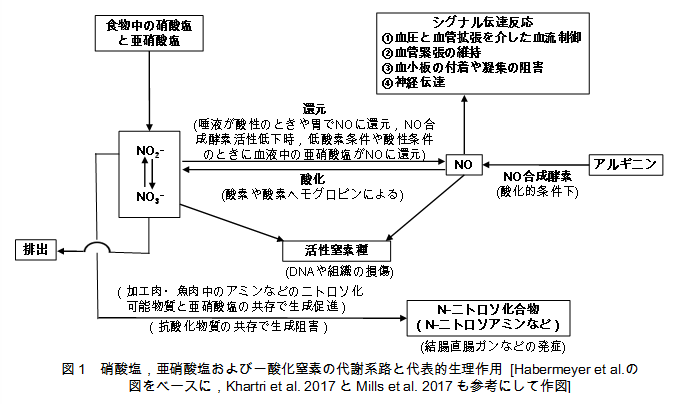
NOはフリーラジカルで,血液中での半減期はミリ秒と非常に短い(文献3)。ラジカルNOは,細胞膜を容易に通過して拡散し,チオール基(R-SH)と反応して,S-ニトロソチオール(R-SNO)を形成する。こうしたNO誘導のS-ニトロソ化プロセスは,細胞中の多数のシグナル伝達反応に関係し,多くの生理機能に影響している。その代表的なものは,図1に示すように,血圧と血管拡張を介した血流の制御,血管緊張の維持,血小板の付着や凝集の阻害や神経伝達がある。
NO合成酵素には,生体内で常に合成されている構成酵素と,ある条件下でだけ合成される誘導酵素の2つのタイプがある。シグナル伝達に関係するNO合成酵素は構成酵素で,酸素や活性酸素の供給がなされている酸化的条件下で作用し,血管内皮に存在し,血管や血液の制御に関係している(文献2)。ただ,神経伝達に関係するNO合成酵素とは,構造の点で若干の違いが存在する。
もう一つの誘導的に作られるNO合成酵素は,細菌,寄生虫やウイルス感染に加えて,胃炎,肝炎や大腸炎のような炎症性疾患に感応して生成されて,NOを合成し,NOが病原菌を死滅させる(誘導的なNO合成は図1にはない)。この他にもNOは生体内でいろいろな機能を果たしている。
・食物中の硝酸塩・亜硝酸塩からのNOの生成
食物は口で咀嚼され,その際に食物中の硝酸塩や亜硝酸塩の一部は唾液に溶け,咀嚼された食べ物とともに飲み込まれて胃に移り,酸性の胃液によって亜硝酸塩の一部はNOに還元されて,胃でカンジダ菌や大腸菌などの有害菌を殺すとされている。また,亜硝酸塩や硝酸塩は胃や上部小腸から急速に吸収されて血液に溶け込み,血漿でのレベルが上昇する。血漿中の硝酸塩の約25%は唾液腺に吸収されて濃縮され,消化管−唾液腺の循環を繰り返していると,硝酸塩を含む唾液が口腔に分泌されてさらに濃縮される。唾液中の硝酸塩の一部は,舌の後ろ3分の1の部分にいる細菌の硝酸塩還元活性によって,亜硝酸塩に還元される。このように,硝酸塩は哺乳類の細胞で効率的に代謝できず,血液を介した消化管−唾液循環を巡りながら,尿として排泄されてゆく(文献3)。
血管中の亜硝酸塩は,NO貯蔵庫として機能し,低酸素条件などでNO合成酵素活性が低下した場合に,NOの主たる供給源となって,生理学的に必要な量のNOを放出できる。このため,虚血,すなわち,動脈血量の減少による局所性貧血を起こしている部位では,血液による酸素供給が低下してNO合成酵素の活性が低下する。こうしたケースでは,血液中の硝酸塩ないし亜硝酸塩が無・低酸素条件下でNOに還元されて,血流増加に寄与する(文献2)。
また,慢性閉塞性肺疾患(COPD)の患者は,肺機能が低下していて,低酸素状態や乳酸アシドーシス(血液の中に乳酸が異常に増えて,血液が酸性になる状態)を生じ,運動能力が低下している。COPDの患者に高硝酸塩のテーブルビートなどのジュースを摂取させて,所定の運動能力試験方法で測定すると,同ジュースなしの場合よりも,運動能力が有意に増加したことや,動脈の酸化ヘモグロビン飽和度が有意に高まった研究結果が,2015年に報告された5つの研究のうち,3つに達した (文献4)。
・NOおよび活性窒素種の害作用
NOは血管拡張などの有益な生理作用を行なっているが,NOは超酸化物(スーパーオキシド)陰イオンラジカルと結合して,生理学的に反応性に富んだ活性窒素種として重要なペルオキシ亜硝酸イオン(ONOO−)などを生成する。生じた活性窒素種のなかには,DNAや組織の損傷を引き起こし,それによって,突然変異,ゲノム不安定性,アポトーシス(細胞自然死),病原菌の殺菌を誘導することも示されている(文献2)。また,亜硝酸塩から生成されたNOが,心筋組織を損傷しうることが示唆されている(文献3)。
人間での研究ではないが,ゼブラフィッシュ(インド原産のコイ科の熱帯淡水魚。和名:シマヒメハヤ。体長4〜5センチ。体表にシマウマ(zebra)のような縦縞がある。)の胚をいろいろな濃度の亜硝酸ナトリウム溶液に暴露させた。その結果,過剰の亜硝酸塩は,血液循環,血管網,心筋および心内膜の発達には影響しなかったものの,心臓が血管のループ化プロセスを開始する受精後36時間から影響し始め,投与量に応じてゼブラフィッシュの心臓の発達障害を引き起こした。受精後48時間では胚の房室管の心内膜細胞の発達が過剰の亜硝酸塩によってめちゃくちゃになり,受精後76 時間では欠陥の弁尖原器が生成された。また,過剰の亜硝酸塩によってNOのシグナル伝達の産物である3’,5’-環状グアノシン一リン酸(cGMP)のレベルが有意に増加したが,NOシグナル伝達の拮抗剤を亜硝酸塩暴露胚にマイクマニピュレータで注入すると,心臓弁の先天性異常が部分的に救済された。こうした結果から,過剰の亜硝酸塩が過剰のNOシグナル伝達を生じさせて,心臓の初期形成に影響することが示された(文献1)。
これらの結果から,血液中の食物由来の硝酸塩や亜硝酸塩は,以前考えられたよりは毒性が少ないとはいえ,硝酸塩や亜硝酸塩から多量のNOが生成するようなケースでは害作用が生じかねないと考えられる。
・N-ニトロソ化合物による発ガンリスク
A.食肉などの加工品
問題とされてきたのは,ニトロソ基 (-NO) をもつ有機化合物である。ニトロソ基が窒素原子に結合している有機化合物がN-ニトロソ化合物で,N-ニトロソアミンとN-ニトロソアミドとがある。
ハム,ソーセージなどの食肉加工品および魚肉加工品や鯨肉ベーコン,イクラや筋子の赤い色を鮮やかに見せるための発色剤として,主に亜硝酸ナトリウム,その他に硝酸ナトリウムや硝酸カリウムが使用されている(硝酸塩は共存する細菌によって亜硝酸塩に変化)。また,肉の熟成では,熟成時に,食塩や亜硝酸塩ナトリウムや亜硝酸カリウムを添加している。その理由は,加工や熟成によって,食肉のミオグロビンが空気に触れ、紅色のミオグロビンがメトミオグロビンに酸化されて褐色に変色し,美味しそうに見えなくなるからだ。ところが亜硝酸塩を添加すると,食肉中の乳酸と反応して亜硝酸を生じ,ミオグロビンやヘモグロビンがニトロソ化されて,赤色のニトロソミオグロビンやニトロソヘモグロビンが生じて,鮮やかな赤色の食肉製品を製造することができる。
肉加工品などの製造過程や熟成過程では,添加物としてニトロソ化反応を引き起こすアミノ化合物(ヒドロキシルアミン誘導体,2級アミンや2級アミドなど)と亜硝酸が使われることが多く,両者からN-ニトロソ化合物が生成される(文献2)。WHO(世界保健機関)傘下のIARC(国際ガン研究機関)は,正式な報告書の予告として,毎日50gの加工肉は大腸がんのリスクを18%増やすと発表した(文献6)。そして,正規の報告書で,肉加工品などの亜硝酸塩や硝酸塩は,体内でニトロソ化合物を生成して,結腸直腸ガンを高いリスクで起こすとして,2Aグループの人間に対する発ガン物質と判定している。なお,2Aグループは,人間に恐らく発ガン作用がある物質で,その発ガン性は実験動物では十分な証拠があるが,人間での証拠は限られているグループである(文献7)。
要するに,硝酸塩/亜硝酸塩摂取による発ガンの危険性は,摂取された硝酸塩/亜硝酸塩で決められるものはなく,体内でニトロソ化を生じやすい条件下にある摂取された硝酸塩/亜硝酸塩によって決められる,つまり,発ガン性のニトロソアミン前駆体の同時投与がないなら,硝酸塩/亜硝酸塩摂取には,発ガン性の証拠がないと結論されている(文献4)。
B.赤肉
2010年のIARC(国際ガン研究機関)の報告(文献7)に先立って,2007年にWCRF(世界がん研究基金)とAICR(アメリカガン研究協会)は,加工肉だけでなく,赤肉(哺乳動物の牛豚羊馬ヤギの肉で,鶏と魚を除く)の過剰摂取も,結腸大腸ガンのリスクを高めることは確実であると評価した(文献8)。これはベジタリアンの食餌に比べて肉類の摂取量が多いと結腸大腸ガンのリスクが高いことなどに基づいている。
国立がん研究センターは,日本人について,肉類の摂取量と大腸ガンの発生率の関係を10府県の約8万人について追跡調査した(文献8)。その結果,肉類全体の摂取量が多いグループ(約100g/日以上の群)で男性の結腸ガンリスクが高くなり,赤肉の摂取量が多いグループ(約80g/日以上)で女性の結腸ガンのリスクが高くなった。そして,男性では,赤肉摂取量によるはっきりした結腸ガンリスク上昇は見られなかった。なお,肉類の摂取量は,実際の量に近似させた値で表示した。
赤肉による大腸ガンリスク上昇のメカニズムは,動物性脂肪の消化における二次胆汁酸,ヘム鉄による酸化作用,内因性ニトロソ化合物の腸内における生成,調理の過程で生成される焦げた部分に含まれるヘテロサイクリックアミン(発ガン物質)などの作用が指摘されている。これらの作用は,牛・豚肉といった赤肉に限らず,肉類全体の摂取を通してももたらされる共通のものといえる。
国立がん研究センターは,赤肉摂取による直接的な大腸ガン発生リスク上昇は男性では観察されなかったが,牛肉・豚肉は肉摂取量全体の85%程度を占めることから,男性でも赤肉摂取による結腸ガンリスク上昇の可能性は否定できないであろうと指摘している。つまり,肉類全体の摂取量と結腸ガンリスク上昇の関連が見られる以上は,牛肉や豚肉も含めて,食べ過ぎないようにする必要があるとしている。そして,日本の国立がん研究センターは,日本人の赤肉・加工肉の摂取量は1日当たり63 gで世界で最も低い国の一つであり,大腸がんの発生に関して,平均的な摂取の範囲であれば赤肉や加工肉がリスクに与える影響はないか,あっても小さいといえるとしている。
・野菜の硝酸塩含量
野菜の硝酸塩含量について,次が指摘されている(文献14)。
硝酸塩の野菜による吸収と蓄積にはいくつかの因子が存在し,遺伝因子(野菜の種類,品種など),環境因子(大気の湿度,培地の水分含量,温度,日照量,日照時間),農業因子(施用窒素の化学形態と施用量,他の養分の利用性,農薬使用など)が関係している。
調べた因子のなかで,窒素施肥と光強度が,野菜の硝酸塩含量に影響する主因子であると確認されている。特に,光強度と収穫の前ないし収穫時の土壌の硝酸塩含量が,葉菜類の硝酸塩レベルを決める重要な因子であることが知られている。
大まかにいえば,硝酸塩の蓄積しやすい野菜は,アブラナ科(ルッコラ,ダイコン,カラシナ),アカザ科(テーブルビート,スイスチャード,ホウレンソウ)およびヒユ科に属しているが,キク科(レタス)とセリ科(セロリ,パセリ)にも高硝酸塩含量のものが存在する。
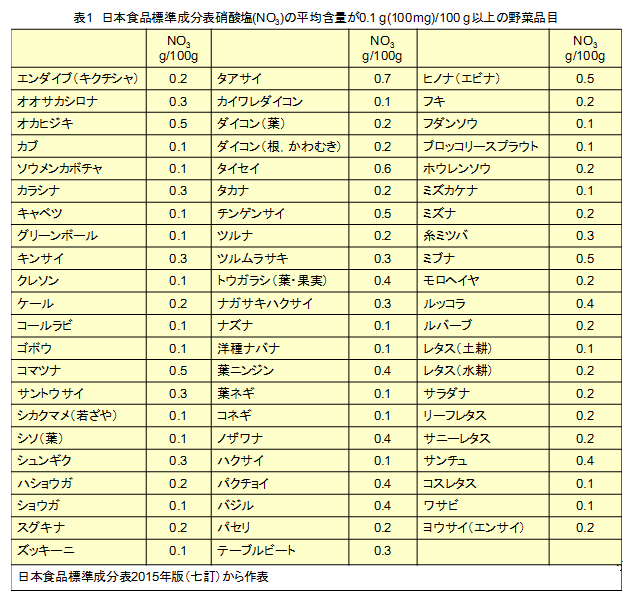
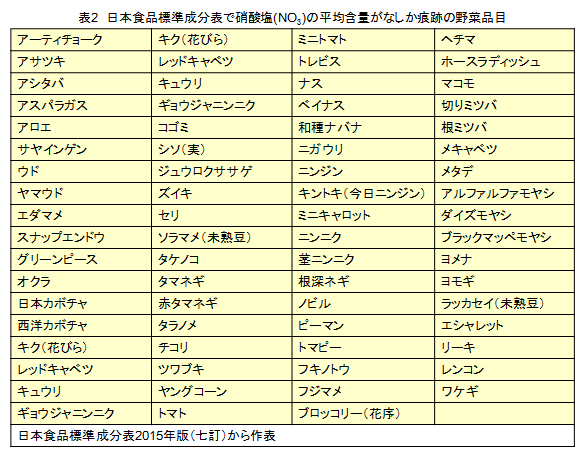
なお,表1と表2は,日本食品標準成分表2015年版(七訂)から,生鮮野菜について,それぞれ硝酸塩濃度が高い品目と,硝酸塩がないか痕跡の品目を抜き書きしたものである。
・野菜による発ガンリスクの低下
2007年のWCRF/AICRの報告書(文献7)は,でん粉質でない野菜や果実に富んだ食事が,口や咽頭,食道,肺,胃,結腸や直腸,喉頭,膵臓,乳房,膀胱に発症するガンから守ることについての証拠は,「可能性が考えられる」(“probable”)に位置付けている。
野菜や果実には発ガン阻害物質が含まれているケースも多い(環境保全型農業レポート「No.277 イソチオシアネートの抗ガン作用とその含量に及ぼす栽培条件の影響」参照)。そうした発ガン阻害物質に加えて,野菜や果実に含まれるアスコルビン酸,タンニンや他のフェノール化合物などの抗酸化物質の存在下で,N-ニトロソ化反応が阻害される。
もう一度,表1を見てもらいたい。この表には硝酸塩を多量に含有しているものが多いので,これらを食すれば,硝酸塩が多量に摂取される。しかし一方で,ニトロソ化を起こさせるアミノ酸などの含窒素化合物が少ないうえに,N-ニトロソ化合物の生成を少なくとも部分的に阻害できる成分が多いために,硝酸塩濃度の高い野菜を摂取しても発ガンリスクは低い。ただし,肉類を多量摂取している場合には,多少の野菜摂取では,発ガンリスクの低下効果は発揮されないであろう。なお,表2に示すように,果菜類など,硝酸塩含量がなし(ゼロ)か痕跡の野菜も多い。
・メトヘモグロビン血症
亜硝酸塩は,血液中のヘモグロビンのヘムの2価の鉄原子を3価に酸化し,残存する亜硝酸塩がこの酸化されたヘムとさらに強固に結合し,酸素の運搬能力を激減させる(文献11)。こうなったヘモグロビンが,メトヘモグロビンと呼ばれている。酸素と結合したヘモグロビンはオキシヘモグロビン(酸素化ヘモグロビン),酸素と結合していないヘモグロビンはデオキシヘモグロビン(脱酸素化ヘモグロビン)と呼ばれる。オキシヘモグロビンは鮮赤色で動脈血の色,デオキシヘモグロビンは暗赤色で静脈血の色である。
とくに生後3か月未満の乳児では,ヘモグロビンが亜硝酸塩によってメトヘモグロビンになりやすい。通常は,メトヘモグロビンの割合はヘモグロビンの3%未満だが,その割合が10%を超えると,酸素不足のために皮膚や粘膜が青紫に変色するチアノーゼ症状を呈し,呼吸が苦しくなり,さらに進むと死に至る(メトヘモグロビン血症)。海外での症例報告が多いが,日本においても北関東の農村で,硝酸性窒素が36.2 mg/Lの井戸水を使って調製した人口乳を飲んだ新生児で,メトヘモグロビン血症が報告されている(田中淳子・堀米仁志・今井博則・森山伸子・齋藤久子・田島静子・中村了正・滝田齊(1996)井戸水が原因で高度のメトヘモグロビン血症を呈した1新生児例.小児科臨床.49: 1661-1665. 環境保全型農業レポート「No.77 日本での井戸水が原因の新生児メトヘモグロビン血症事例」)。
生後3か月未満の乳児がメトヘモグロビン血症に感受性が高い原因として,メトヘモグロビンに酸化されやすい胎児性ヘモグロビンの存在,メトヘモグロビンをヘモグロビンに戻す還元酵素の欠乏,および,胃のpHがまだ高くて,生息する細菌によって硝酸塩の亜硝酸塩への高い還元率が指摘されている(文献11)。メトヘモグロビン血症は乳児や児童で起きやすいが,事故や医療行為によって多量の硝酸塩を投与された場合,大人でも生じることがある。
・EUの野菜の硝酸塩含量の上限濃度に関する法律
EUは,とくに乳児や幼児のメトヘモグロビン血症の危険を回避するために,一部の野菜について,1997年から硝酸塩の上限濃度を法律で規定している。
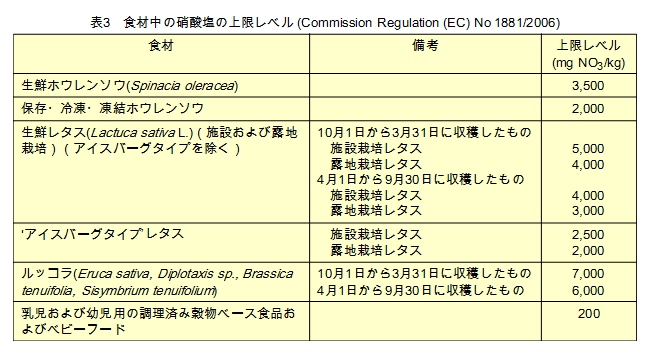
対象にしている野菜は,1997年の時点では,生鮮のホウレンソウとレタスならびに保存,冷凍ないし凍結したホウレンソウが対象であったが,EUは野菜の硝酸塩含量を低下させる技術の普及状況,野菜の硝酸塩の摂取状況などに基づいて,野菜の硝酸塩の上限レベルの規制を見直している。2002年時点(環境保全型農業レポート「No.51 イギリスの葉菜類の硝酸含量調査結果」参照)に比べて,2011年にいくつかの変更がなされている(表3)(Commission Regulation (EU) No 1258/2011 amending Regulation (EC) No 1881/2006 as regards maximum levels for nitrates in foodstuffs. )。
表3を見ていただくとわかるが,生鮮レタスで,秋冬(10月1日〜3月31日)と春夏(4月1日〜9月30日)の収穫物について,施設栽培と露地栽培に分けて硝酸塩濃度を分けて規定している。これは次の理由による。
すなわち,一般に植物は土壌に硝酸塩が十分供給されていると活発に吸収するが,光や温度などの環境条件が良ければ,活発な光合成を行なって,吸収した硝酸塩から蛋白質などを合成して,収穫物の硝酸塩濃度が低くなる。これに対して,光合成が不活発な条件では,吸収した硝酸塩が蛋白質などの合成に少ししか使われずに,高濃度の硝酸塩が体内に長く残存してしまう。EU加盟国から提出された野菜の硝酸塩含量に関するデータを見ても,冬でも温暖で光の多い南ヨーロッパで露地生産したものに比べて,北ヨーロッパや中央ヨーロッパで秋・冬に施設生産したレタスでは,硝酸塩含量に有意な差が存在した。そのため,こうした区別がなされている(文献12)。
地域によって上限濃度を区別したのは,秋から冬の生産条件の不利な地域の生産者を保護することと,そうした地域では秋から冬の生産量が少なくて,消費者による消費量も多くないことがデータで確認されたためである。
2002年時点の規制値と表3には,いくつかの変更点が存在する。
1つには,2002年時点では,生鮮ホウレンソウについても,収穫時期によって硝酸塩の上限濃度が異なっていたのが,優良農業技術基準の励行によって,ホウレンソウの硝酸塩濃度が低下したため,2011年の変更で,収穫時期による上限濃度の違いが廃止された。
2つには,秋から冬の日照量が少ない国々では硝酸塩濃度が高くなりやすいので,2002年時点では,そうした国々について上限濃度を超えたホウレンソウを他の加盟国に輸出することができないが,自国内で販売することを例外措置として認めていた。しかし2011年の変更で,この例外措置を廃止した。
3つには,硝酸塩含量が非常に高いルッコラが、品目として追加された
・野菜の硝酸塩のADI
ADI(一日摂取許容量)は,食品中の特定の物質について,生涯にわたり毎日摂取し続けても影響が出ないと考えられる一日当たりの量で,硝酸塩のADIは,FAOとWHOの合同委員会ならびにヨーロッパ委員会の「食品に関する科学委員会」によって,0-37 mg NO3/kg体重(成人で1人1日当たり222 mg)と設定されている。
EUでは,加盟国から提出された食品の硝酸塩含量と食品の摂取量に関するデータに基づいて,飲料水や熟成肉などの野菜・果実以外の食品から,1人1日当たり平均35-44 mg,野菜・果実から平均157 mgの硝酸塩に暴露されていて,硝酸塩のADIを超えていないとしている(文献12)。野菜の硝酸塩の毒性は,飲料水や熟成肉などよりは低く,それは野菜の抗酸化物質がメトヘモグロビン生成を阻害するためとされている(文献13)。このため,野菜の硝酸塩の毒性をADIによって評価するのは適切ではないが,他に有効な指標がないために,ADIが用いられている。このため,摂取した野菜の硝酸塩がADIを超えることが少なくないが,多少超えても特段の問題はない。しかし,野菜の硝酸塩を削減してADIを超えないようにすることが予防手段として望ましいことは,広く受け入れられている。このため,硝酸塩含量が非常に高いルッコラを新たに規制対象に加えている。
表3の規制値は,乳幼児のメトヘモグロビン血症を念頭においた規制であるが,表3の規制値を超える野菜をEU域内で販売することは,成人が食するとしても,許されていない。
・おわりに
最近,乳児や児童で生じたメトヘモグロビン血症が生じた事例を解析した結果によると,その大部分は水が硝酸塩や亜硝酸塩で汚染されていた場合と,24時間よりも前に調製して室温保存した野菜のピュレ(ピュレは,野菜をやわらかく茹でるか加熱してミキサーなどにかけて、とろみのある半液体状にしたもので、その保存中に細菌によって亜硝酸塩が生成)を乳幼児に与えた場合である(文献13)。こうした場合を除き,調理したての野菜料理でメトヘモグロビン血症が生じた事例の報告は,最近では認められていないようである。そのために,EUは表3の法律で規定された野菜を筆頭に,野菜の硝酸塩含量を引き下げる過剰施肥の回避などの生産基準を農業者に普及させている。
抗酸化物質であるアスコルビン酸を添加してラットや人間の赤血球と一緒に培養すると,亜硝酸塩だけで培養した赤血球に比べて,濃度に依存した形でメトヘモグロビン生成が有意に減少することが示されている(文献12)。このように,野菜に共存する抗酸化物質によって,亜硝酸塩からのメトヘモグロビンの生成が有意に減少する事例が多く報告されている。
野菜の硝酸塩は,以前に考えられたほどは有毒ではない。だからといって過剰施肥で硝酸塩含量の高い野菜を生産する一方,地下水を硝酸塩汚染して,飲料水を汚染すれば,そのことによってもメトヘモグロビン血症のリスクが高まり,硝酸塩やリン酸で富栄養化した表流水によって,アオコの発生など環境劣化を助長してしまう。環境保全と農産物の品質と安全性の向上を同時に実現させなければならない(文献14)。